KẾT QUẢ NGHIÊN CỨU VỀ ĐỘT BIẾN VI SINH VÀ HƯỚNG NGHIÊN CỨU
1. Nghiên cứu ứng dụng bức xạ ion hóa kết hợp công nghệ ribosome nhằm cải thiện khả năng sinh protease của chủng vi sinh vật Bacillus subtilis
Protease là nhóm enzyme có chức năng phân giải các liên kết peptide của protein để tạo thành các acid amine đơn lẻ. Với tiềm năng ứng dụng to lớn trong nhiều lĩnh vực đời sống nên protease đang thu hút mối quan tâm của nhiều nhà khoa học cũng như các công ty hóa dược lớn trên thế giới. Theo tính toán, thị trường toàn cầu về enzyme protease ước tính trị giá 708,5 triệu USD vào năm 2023, dự kiến sẽ đạt quy mô khoảng là 933,3 triệu USD vào năm 2031 [1].
Vi sinh vật, đặc biệt là chủng VK Bacillus là nguồn nguyên liệu thích hợp để sản xuất protease ở quy mô công nghiệp nhờ việc thu nhận sản phẩm dễ dàng, nuôi cấy đơn giản và đặc biệt protease của chủng VK này có hoạt tính ổn định ở các điều kiện pH, nhiệt độ cao [2]. Tuy nhiên, các chủng Bacillus tự nhiên thường cho năng suất sinh protease không cao và vì thế việc tạo ra các thể đột biến có khả năng sinh sản phẩm thứ cấp vượt trội là một lựa chọn lý tưởng cho ngành công nghiệp sản xuất protease.
Trong tự nhiên, tỷ lệ đột biến phụ thuộc vào điều kiện phát triển của vi sinh vật và nằm trong khoảng từ 10-10 đến 10-6. Tỷ lệ này có thể tăng một cách rõ rệt bằng cách sử dụng các tác nhân gây đột biến thực nghiệm và thực tế có thể lên đến 10-5 đến 10-1 [3]. Các tác nhân vật lý như: các tia X, tia g, notron có bước sóng ngắn nên có khả năng ion hóa và khả năng xuyên sâu cao. Các tia phóng xạ có thể gây đột biến bằng cách làm đứt gãy ADN, thay đổi cấu trúc của ADN hoặc hình thành các hợp chất có hoạt tính không ổn định làm biến đổi ADN. Bức xạ ion hóa có thể tạo ra đột biến tại những vị trí xác định nhằm cải thiện hoạt tính của vi sinh vật [4].
Nhiều nghiên cứu cho thấy một số thể đột biến kháng kháng sinh ở vi sinh vật có thể tăng cường sản xuất sản phẩm thứ cấp như enzyme, sắc tố, kháng sinh [5, 6, 7] cũng như tăng khả năng chịu hợp chất độc hại [8]. Ở Bacillus subtilis, đột biến kháng streptomycin làm tăng lượng sản phẩm enzyme α – amylase lên 20 – 30% và lượng sản phẩm cũng tăng từ 1,5 – 2 lần với thể đột biến kháng rifampicin [9]. Cơ chế phân tử liên quan được phân tích, đánh giá trong nhiều công trình nghiên cứu cho thấy sự tác động này chủ yếu theo hai con đường chính là gây đột biến gen rpsL mã hóa cho protein ribosome S12 và gây đột biến gen rpoB mã hóa cho tiểu phần β của RNAP [5, 6, 10]. Đây cũng là cơ sở cho sự ra đời của công nghệ ribosome (Ribosome Engineering), một kỹ thuật khá mới liên quan đến việc gia tăng hoạt tính của các ribosome tham gia dịch mã, nhằm mục đích tăng khả năng dịch mã. Như vậy gen đích không hề bị cải biến nhưng khả năng sinh tổng hợp sản phẩm của gen được tăng lên nhờ các đột biến liên quan đến bộ máy tổng hợp ribosome. Kỹ thuật này đã chứng minh được tính hiệu quả, có thể làm tăng khả năng sinh tổng hợp lên hàng chục, thậm chỉ hàng trăm lần. Trong khi, theo báo cáo của một số công ty công nghệ sinh học trên thế giới, đa số các chủng vi sinh vật tái tổ hợp có năng suất cao hơn chủng tự nhiên không quá vài lần, một số ít trường hợp đạt được vài chục lần [6]. Ngoài ra, một số sản phẩm dùng để sản xuất thực phẩm hoặc dùng vào mục đích bảo quản thực phẩm chưa cho phép sử dụng các protein tái tổ hợp.Việc áp dụng công nghệ ribosome sẽ giúp khắc phục những hạn chế này.
Rõ ràng, công nghệ ribosome là một kỹ thuật gây đột biến định hướng, tương đối đơn giản, hiệu quả và đặc biệt chi phí thấp so với công nghệ gen. Tuy nhiên, thời gian sàng lọc đột biến ribosome khá dài, tốn nhiều công sức vì vậy việc sử dụng kết hợp công nghệ ribosome với xử lý chiếu xạ được xem là một giải pháp nhằm làm tăng áp lực chọn lọc, giảm thời gian sàng lọc, tăng tần suất thu được thể đột biến mong muốn, đặc biệt là tăng khả năng kháng với kháng sinh của vi sinh vật [11, 12].
Như vậy, cùng với kỹ thuật gây đột biến phóng xạ, công nghệ ribosome có thể giúp tạo ra chủng vi sinh vật có khả năng sinh tổng hợp enzyme cao hơn chủng thuần nhiều lần, giúp tăng khả năng ứng dụng thực tiễn của nghiên cứu. Vì lý do đó, đề tài "Nghiên cứu ứng dụng bức xạ ion hóa kết hợp công nghệ ribosome nhằm cải thiện khả năng sinh protease của chủng vi khuẩn Bacillus subtilis" đã được nhóm nghiên cứu Phòng Nghiên cứu Công nghệ Bức xạ, Trung tâm Chiếu xạ Hà Nội (Viện Năng lượng Nguyên tử Việt nam) và Phòng Thí nghiệm Sinh Y, Phòng thí nghiệm Sinh học Phân tử, Khoa Sinh học (Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội) phối hợp thực hiện với một số kết quả chính như sau:
- Tuyển chọn được 3 chủng Bacillus subtilis có khả năng sinh protease cao làm nguyên liệu gây tạo đột biến. Xử lý chiếu xạ các chủng Bacillus subtilis trong khoảng liều 700-1500 Gy cho tỷ lệ đột biến sinh protease cao hơn chủng thuần.
- Sử dụng kết hợp chiếu xạ tia gamma và xử lý kháng sinh cũng như tăng dần nồng độ kháng sinh trong quá trình sàng lọc đã tạo ra 17 khuẩn lạc kháng xạ, kháng kháng sinh có khả năng sinh protease vượt trội so với các chủng thuần ban đầu. Kết quả giải trình tự cho thấy14/17 khuẩn lạc đều mang đột biến thay thế ở gen rpoB. Không có bất kì đột biến nào trên gen rpsL được phát hiện ở tất cả các khuẩn lạc nghiên cứu.
- Trong số các đột biến thì dòng 609-B5 (tạo được nhờ chiếu xạ liều 500 Gy chủng thuần Bacillus subtilis B5 kết hợp xử lý streptomycin 200 µg/ml) và dòng 19-H12 (tạo được nhờ chiếu xạ liều 1000 Gy chủng thuần Bacillus subtilis H12 kết hợp xử lý rifampicin 10 µg/ml) có khả năng sinh protease cao hơn 2,5-2,7 lần so với chủng gốc và ổn định so với các đột biến còn lại.
- Trình tự nucleotide gen rpoB của dòng 609-B5 và dòng 19-H12 đã được đăng ký trên NCBI (National Center for Biotechnology Information). Đồng thời, 02 plasmid chứa gen rpoB đột biến của chúng đã được tái tổ hợp, biến nạp và tách chiết thành công.
- Phương pháp mô hình hóa RSM - CCD kết hợp với phần mềm tin sinh Design Expert và kiểm tra bằng thực nghiệm đã xác định điều kiện tối ưu của bốn yếu tố trong nuôi cấy dòng đột biến 609-B5 thu protease cực đại là 2299,49 UI/ml ở các giá trị hàm lượng hàm lượng pepton 6,5 g/l, hàm lượng cao thịt 2 g/l, pH 7,16, thời gian nuôi cấy là 21 giờ.
Đây là nghiên cứu khởi đầu kết hợp giữa công nghệ bức xạ với công nghệ ribosome tại Việt Nam. Các kết quả thu được sẽ là cơ sở khoa học để phát triển phương pháp mới trong gây tạo đột biến vi sinh vật.
Một số hình ảnh của đề tài
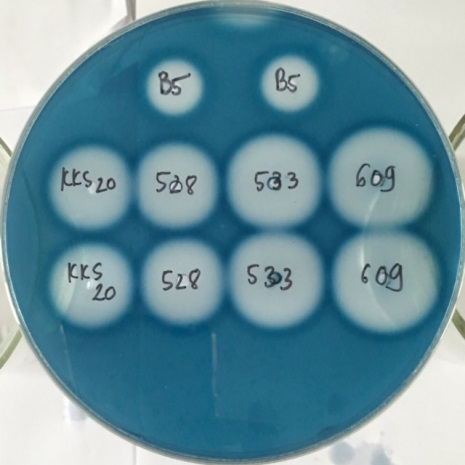
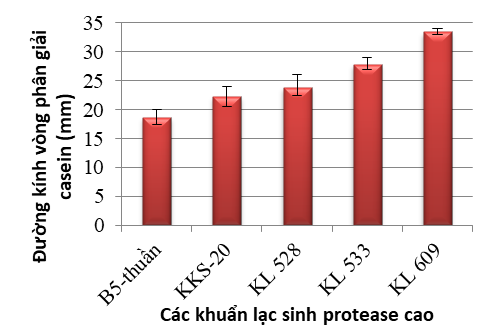
Kích thước vòng phân giải casein của chủng Bacillus subtilis B5 thuần và của các khuẩn lạc kháng streptomycin xuất phát từ chủng thuần chiếu xạ liều 500 Gy.
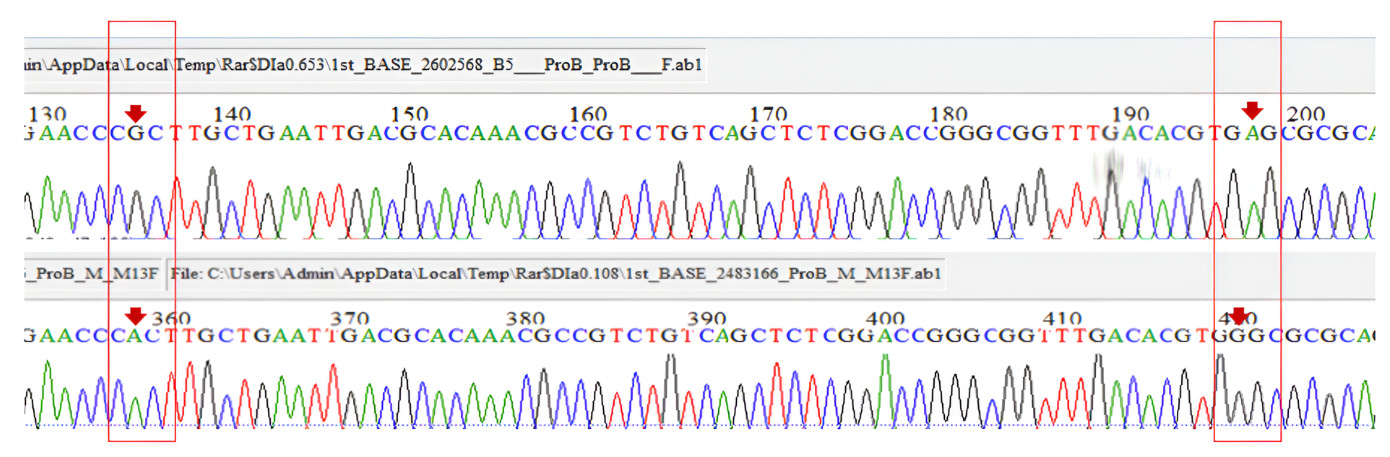
Trình tự gen rpoB của chủng thuần (B5_rpoB) với khuẩn lạc đột biến 609 (rpoB-M). Vị trí đột biến được chỉ ra bằng mũi tên đỏ.
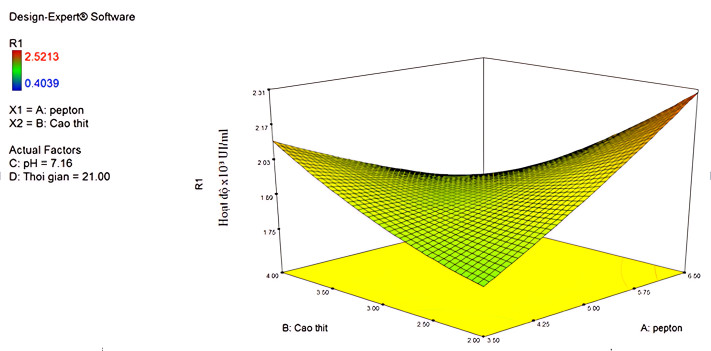
Bề mặt đáp ứng của hoạt độ enzyme dưới tác động của các điều kiện tối ưu
Tài liệu tham khảo:
1. http://www.prnewswire.co.uk/news-releases/protease-enzymes-market
2. Olajuyigbe, F.M. and Ajele, J.O., 2005. Production dynamics of extracellular protease from Bacillus species. African Journal of Biotechnology. 4, 776-779.
3. Davati, N., Najafi, M. B. H., 2013. Overproduction strategies for microbial secondary metabolites: A review. Life Science. 3, 23–37.
4. Awan, S. D., Tabbasam, N., Ayub, N., Babar, M. E., Rahman, M., Ran, S. M., Rajoka, M. I., 2011. Gamma radiation induced mutagenesis in Aspergillus niger to enhance its microbial fermentation activity for industrial enzyme production. Mol. Biol. Rep. 38, 1367-1374.
5. Ochi, K., 2007. From microbial differentiation to ribosome engineering.Biosci Biotechnol Biochem. 71, 1373–1386.
6. Wang, G., Hosaka, T., Ochi, K., 2008. Dramatic activation of antibiotic production in Streptomyces coelicolorby cumulative drug resistance mutations.Appl Environ Microbiol. 74, 2834–2840.
7. Ochi, K., Hosaka, T., 2013. New strategies for drug discovery: activation of silent or weakly expressed microbial gene clusters. Appl Microbiol Biotechnol. 97, 87– 98.
8. Hosokawa, K., Park, N.H., Inaoka, T., Itoh, Y., Ochi, K., 2002. Streptomycin – resistant (rpsL) of rifampicin – resistant (rpoB) mutation in Pseudomonas putida KH146 – 2 confer enhnced tolerance to organic chemical.Environ Microbiol. 4, 703–712.
9. Kurosawa, K., Hosaka, T., Tamehiro, N., Inaoka, T. and Ochi, K., 2006. Improvement of α – amylase production by modulating the ribosomal component S12 protein in Bacillus subtilis 168.Appl. Environ. Microbiol. 72, 71–77.
10. Lai, C., Xu, J., Tozawa, Y., Hosoya, Y., Yao, X., Ochi, K., 2002. Genetic and physiological characterization of rpoB mutations that activate antibiotic production in Streptomyces lividans.Microbiology. 148, 3365–3373.
11. De Groot, A., Chapon, V., Servant, P., Christen, R., Fischer-Le Saux, M., 2005. Deinococcus deserti sp. nov., a gamma-radiation-tolerant bacterium isolated from the Sahara Desert. Int J Syst Evol Microbiol. 55, 2441–2446.
12. Al-Sudany, G. A., Majeed, W. Z., Al-Aubeidi, H. J., 2010. Detection of gamma radiation effect induced by colbelt-60 on Escherichia coli cells. Journal of Al-Nahrain university Science. 13(3), 129-133.
2. Ứng dụng bức xạ gamma gây đột biến Trichoderma để tạo chế phẩm phân giải nhanh rơm rạ trên đồng ruộng.
Việt Nam là nước nông nghiệp có sản lượng lúa gạo đứng hàng đầu thế giới với hàng triệu tấn rơm rạ để lại sau thu hoạch mỗi năm. Đốt rơm rạ đã trở thành thói quen từ lâu của nông dân nhiều nước Đông Nam Á trong đó có Việt Nam. Tuy nhiên, nhiều nghiên cứu chỉ ra rằng đốt rơm rạ ngay trên đồng ruộng sẽ làm mất chất dinh dưỡng của đất. Đốt đồng nhiều lần và lâu dài sẽ làm cho đất biến chất và trở nên chai cứng, dẫn đến phát sinh nhiều bệnh dịch hại lúa. Ngoài ra, khói rơm gây nguy hại tới sức khỏe do đốt rơm rạ gây nên ô nhiễm bụi mịn - một loại bụi độc hại khi chui sâu vào phổi gây các bệnh về hô hấp, thậm chí ung thư [1]. Để giải quyết vấn đề này, đồng thời giảm được lượng phân bón sử dụng trong nông nghiệp thì phân hủy rơm rạ ngay trên đồng ruộng theo cách tự nhiên là một lựa chọn. Việc bổ sung thêm các loài VSV có khả năng phân hủy cellulose mạnh như một số loài nấm sợi, xạ khuẩn,vi khuẩn… vào nguyên liệu chứa cellulose hay rơm rạ trên đồng sau thu hoạch giúp việc phân hủy được nhanh chóng, triệt để, mang lại hiệu quả lâu dài và không gây ô nhiễm cho MT mà các thuốc hóa học không thể sánh kịp.
Trichoderma spp. là loại nấm sợi hiện diện gần như trong tất cả các loại đất và trong nhiều môi trường sống khác. Nhờ việc nuôi cấy dễ dàng, không tốn kém cùng với khả năng tiết enzyme cellulase hoạt tính cao gấp vài trăm lần so với vi khuẩn [2] mà các chủng Trichoderma đã thu hút được sự quan tâm đặc biệt. Cellulase ngoại bào từ một số chủng Trichoderma thường tồn tại dưới dạng tổ hợp đa enzyme (cellulosome) nhờ vậy mà chúng thủy phân hiệu quả cả vùng vô định hình và vùng tinh thể của cellulose. Trong khi đó, các enzyme đơn lẻ hoặc kể cả hỗn hợp của chúng không thực hiện đồng thời cả hai chức năng trên [3].
Để cải thiện khả năng sinh cellulase của Trichoderma nhiều nghiên cứu gây đột biến chủng nấm này bởi bức xạ tia gamma đã được thực hiện. Trong nghiên cứu của Shahbazi và cộng sự (2014), hoạt tính cellulase của Trichoderma reesei đã được cải thiện tăng 1,5-1,99 lần nhờ tác nhân đột biến tia gamma [3]. Khả năng tiết cellulase của Trichoderma reesei cũng tăng lên 1,8 lần bởi xử lý chiếu xạ gamma liều 2 kGy trong khảo sát của Tamada và cộng sự (1987) [4]. Trên cơ chất là bã mía, chủng Trichoderma viride được xử lý chiếu xạ liều 20 krad 2 lần liên tiếp có hoạt tính sinh cellulase tăng 253,5% thay vì chỉ tăng 134,5% khi xử lý 1 lần ở cùng liều chiếu [5].
Nghiên cứu gần đây của chúng tôi cho thấy phương pháp chiếu xạ có nhiều ưu điểm trong việc cải thiện khả năng sinh sản phẩm thứ cấp ở vi sinh vật như phổ đột biến rộng, tần suất đột biến cao… [6]. Tuy nhiên, khả năng tự phục hồi, sửa chữa của vi sinh vật đòi hỏi quá trình sàng lọc đột biến phải tiến hành tức thời ngay sau khi xử lý chiếu xạ. Do vậy các nghiên cứu gây đột biến bằng bức xạ trên vi sinh vật chỉ khả thi khi cơ sở nghiên cứu được trang bị nguồn chiếu xạ đồng bộ với phòng thí nghiệm vi sinh. Phòng Công nghệ Bức xạ, Trung tâm Chiếu xạ đáp ứng được yêu cầu này.
Mặt khác, trên thị trường, các chế phẩm sinh học phân hủy phế phụ phẩm nông nghiệp có nguồn gốc Trichoderma chủ yếu được nhập khẩu hoặc sản xuất từ các chủng có hoạt tính cao thu được qua các quá trình phân lập, tuyển chọn các chủng giống tự nhiên. Việc tạo ra các chủng Trichoderma đột biến có hoạt tính cellulase vượt trội giúp chủ động nguồn giống chất lượng ứng dụng cho sản xuất chế phẩm vẫn chưa được quan tâm nghiên cứu và phát triển đúng cách.
Vì lý đó, đề tài “Ứng dụng bức xạ gamma gây đột biến Trichoderma để tạo chế phẩm phân giải nhanh rơm rạ trên đồng ruộng” được thực hiện tại Phòng Nghiên cứu Công nghệ Bức xạ, Trung tâm Chiếu xạ Hà Nội (Viện Năng lượng Nguyên tử Việt nam) với một số kết quả chính, cụ thể là:
- Tuyển chọn được 2 chủng T. koningiopsis VTCC 31435 và T. reesei VTCC 31572 có khả năng sinh protease cao làm nguyên liệu gây tạo đột biến. Xử lý chiếu xạ các chủng nấm này trong khoảng liều 700-1500 Gy để có được tỷ lệ đột biến sinh cellulase cao hơn chủng thuần.
- Từ hàng trăm khuẩn lạc kháng xạ- sinh celluase cao, sau sàng lọc đã lựa chọn được các dòng đột biến tiềm năng có hoạt tính cellulase vượt trội và ổn định. Tiêu biểu là dòng VTCC(k) I-1(có nguồn gốc từ chủng thuần T. koningiopsis VTCC 31435) có hoạt độ CMCase là 2,753 (cao hơn chủng gốc là 2,48 lần) và hoạt độ FPase là 0,365 U/ml (cao hơn chủng gốc 1,87 lần). Ngoài ra, dòng VTCC(r)-1 (sàng lọc từ chủng T. reesei VTCC 31572) có hoạt độ CMCase là 3,02 (cao hơn chủng gốc là 2,47 lần), hoạt độ FPase là 0,434 U/ml (cao hơn chủng gốc 2,29 lần).
- Đã phát hiện 1 đột biến dẫn đến thay thế gốc amino acid alanine thành threonin ở vị trí 325 và thêm một bộ ba arginine vị trí 413 trên gen mã hóa endoglucanase của dòng đột biến VTCC(r)-1 so với chủng thuần. Những thay đổi này có thể đã làm tăng mức độ sinh tổng hợp cellulase của VTCC(r) I-1.
- Xác định được các thông số kỹ thuật tối ưu để lên men bán rắn 2 chủng đột biến VTCC(k) I-1 và VTCC(r) I-1. Sau lên men và thu nhận riêng rẽ, BT các chủng đột biến được phối trộn với nhau để tạo được hỗn hợp BT Trichoderma có mật độ lớn hơn 1010CFU/g.
- Tạo được chế phẩm phân hủy cellulose IRTr từ hỗn hợp BT Trichoderma với chất mang (có thành phần chính là tinh bột và xanthan đã được chiếu xạ thanh khử trùng ở liều 15 kGy). Chế phẩm IRTr tạo ra có chỉ tiêu kỹ thuật đáp ứng TCVN 6168: 2002, đồng thời chất lượng được duy trì ít nhất 6 tháng sau khi sản xuất.
- Thử nghiệm ở quy mô phòng thí nghiệm và đồng ruộng cho thấy, rơm rạ được xử lý chế phẩm IRTr phân hủy nhanh và hiệu quả hơn so với sử dụng một số loại chế phẩm thương mại có nguồn gốc Trichoderma.
Một số hình ảnh của đề tài
.jpg)
.jpg)
Nhân giống và sản xuất chế phẩm IRTr


Thử nghiệm khả năng phân hủy rơm rạ của chế phẩm IRTr trên đồng ruộng
Tài liệu tham khảo:
1. http://vea.gov.vn/vn/quanlymt/: Sức khỏe môi trường
2. Xu F., Wang J., Chen S., Qin W., Yu Z., Zhao H., Xing X., H. (2011): Strain improvement for enhanced production of cellulose in Trichoderma viride, Appl biochem microbial. 47, 53-58.
3. Shahbazi S., Ispareh K., Karimi M., Askari H., Ebrahimi M.A. (2014): Gamma and UV radiation induced mutagenesis in Trichoderma reesei to enhance cellulases enzyme activity. Int J Farming Allied Sci, 3, 543–554.
4. Tamada M., Kasai N., and Kaetsu I. (1987): Effects of gamma-ray irradiation on cellulase secretion of Trichoderma reesei. J Ferment Technol ,65(6), 703–705.
5. El-Zawahry Y., Mostafa Y. (1991): Study on the production of cellulase enzyme by non-irradiated and irradiated isolates of Trichoderma viride. Rad. Res, 15, 103-11.
6. Diep T.B., Thom N.T., Sang H.D., Thao H.P., Binh N.V., Thuan T.B., Lan V.T.T., Quynh T.M. (2016): Screening streptomycin resistant mutations from gamma ray irradiated Bacillus subtilis B5 for selection of potential mutants with high production of protease. VNU J Sci Nat Sci Technol, 32(1S), 170-176.
Phòng Nghiên cứu Công nghệ Bức xạ